بسم الله الرحمن الرحيم
تحليل معادلة اليكترونات مستويات الطاقة
حسب بنية الذرة وخصائص الذرة المعروفة , تعرف بعض مبادىء وتعريفات , منها المعادلة الخاصة بعدد الاليكترونات التى تملأ مستويات الطاقة .
وهى معادلة واضحة الخطأ .
وسأقوم بتفصيل خطأ هذة المعادلة .
بعون الله وتوفيقة .
أولا :
تقسم مستويات الطاقة الى سبع مستويات للطاقة .
هناك معادلة تبين عدد الاليكترونات التى تملأ مستوى الطاقة الاساسى , بالنسبة للمستويات الاربعة الاولى .
وهى ن = 2ن تربيع . حيث ن الأولى تعبر عن عدد الاليكترونات , " ن " الثانية , هى رقم المستوى الاساسى .
وهذة المعادلة لاتطبق على المستويات الأعلى من المستوى الرابع , لسبب عدم أستقرار الذرة ذات العدد الذرى الكبير .
التحليل :
تعريف المعادلة , وتصنيف المستويات الأساسية :
بتطبيق المعادلة على المستويات الأربعة الاولى , يتضح التالى :
عدد الاليكترونات التى يمتلأبها المستوى الاول = 2 * 1 تربيع = 2
عدد الاليكترونات التى يمتلأبها المستوى الثانى = 2 * 2 تربيع = 2 *4 = 8
عدد الاليكترونات التى يمتلأبها المستوى الثالث = 2 * 3 تربيع = 2 * 9 = 18
عدد الاليكترونات التى يمتلأبها المستوى الرابع = 2 * 4 تربيع = 2 *16 = 32 اليكترون .
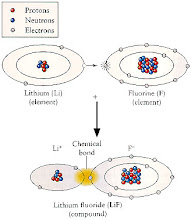
من المعلوم أن العدد الذرى للعنصر الخامل , هو العدد المميز لعدد الاليكترونات التى يمتلأ بها مستوى الطاقة .
وبالنظر للعدد الذرى لأول أربع عناصر خاملة , الهيليوم , النيون , الارجون , الكريبتون .
وهى الأعداد 2 , 10 , 18 , 36 ...
بالملاحظة , نجد أن ,
العدد المباشر لملأ مستوى الطاقة الأول والثالث , هو العدد المباشر للعدد الذرى للعنصر الخامل . وهو العدد 2 و 18 .
وأما المستوى الثانى , فيجب عمل عملية جمع , لعدد المستوى الأول مع الثانى ,
لينتج العدد 10 , ليماثل العدد الذرى للعنصر الخامل النيون .
والمستوى الرابع , يمتلأ بعدد 32 اليكترون , وهو ليس نفس رقم العدد الذرى للعنصر الخامل الرابع " الكريبتون - 36 " , سواء بطريقة مباشرة ,
أو بعد عملية جمع .
وتتلخص الملاحظات فى :
1 - لماذا يتم عملية جمع عدد المستوى الاول مع الثانى , ولايتم مثل هذة العملية مع المستويات الاخرى .
2 – العدد الذرى 32 , هوالعدد الذرى لعنصر الجرمانيوم , وهو عنصر نشط من أشباة الموصلات ,
وهو رباعى التكافؤ , وليس عنصر خامل .
3 - عدم تطبيق المعادلة مع المستويات ذات العدد الذرى الكبير , ليس لسبب صحيح علميا , لوجود عناصر كثيرة ,
ذات عدد ذرى أكبر من 36 فى حالة مستقرة تماما ,
وأشهرها المعادن المعروفة , الفضة , الذهب , البلاتين , الرصاص .
ذات الاعداد الذرية 47 , 78 , 79 , 82 .
بل ان الرصاص ليس عنصر مستقر فقط , بل ويستخدم فى الحماية من الاشعاعات الصادرة من العناصرغير المستقرة , ذات النشاط الاشعاعى .
وفى نفس الوقت يوجد عناصر ذات عدد ذرى صغير , فى حالة غير مستقرة , ولها نشاط أشعاعى مثل الكربون 14 , والصوديوم 24 ,
والكوبلت 60 الذى يستخدم فى التطبيقات الطبية , فى العلاج من السرطان .
ووجود العنصر فى حالة مستقرة أو فى حالة مشعة – غير مستقرة – لايتوقف على العدد الذرى الكبير أو الصغير ,
بل بالوزن الذرى للعنصر , ونسبة عدد البروتونات الى النيوترونات فى النواة .
ثانيا :
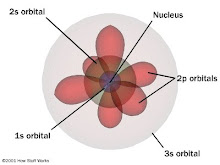
الشكل المميز لمستويات الطاقة المختلفة ليس معروف ,
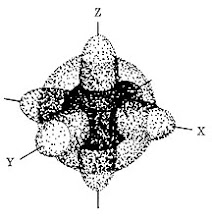
ومما يعرف من شكل المستويات , هو شكل المستوى الثانى الفرعى , بى , حيث يميز شكلة بأن لة اتجاهات ثلاثة ,
تصنع الاتجاهات الفراغية المتعامدة , اكس , واى , زد .
التحليل :
المستوى الفرعى الثانى بى , المعروف بالاتجاهات الفراغية الثلاث , ليس هناك ما يؤكد أن المستويات الفرعية الاعلى , 2بى أو 3بى ,
... لها نفس الاتجاهات .
بالأضافة الى ذلك , فأننى أستطيع القول بالتأكيد , أن الاتجاهات الفراغية المميزة للمستوى الفرعى الثانى , بى ,
ليست لمستوى الطاقة الثانى الفرعى بى بالفعل , بل هى مستويات طاقة ذرة الكربون 6 - 12 ,
أى أنها للمستوى الاول , وجزء من المستوى الثانى . - حسب التصنيف المعروف لمستويات الطاقة -
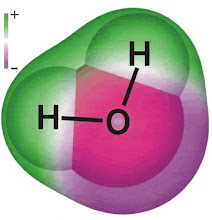
ومن قام بدراسة جزىء الميثان , سيلاحظ بوضوح ,
أن روابط جزىء الميثان الاربعة هى نفس زوايا المدارين , واى , زد . لمستوى الطاقة الفرعى , بى .
ثالثا :
خطأ ترتيب المستويات حول النواة :
تترتب المستويات فى وجودها حول النواة , فى سلسلة تصاعدية حسب الطاقة , وهى :
1 اس , 2 اس , 2 بى , 3اس , 3 بى , 4 اس , 3 دى , ... وهكذا .
التحليل :
حسب ترتيب مستويات الطاقة , يترتب مستوى الطاقة الفرعى اس , بصورة غير منتظمة .
فأحيانا يسبق المستوى الفرعى بى , وأحيانا بسبق المستوى الفرعى دى , وأحيانا يسبق مستوى الطاقة أف .
والسئوال هنا , لماذا يكون ذللك ؟ هل هناك شكل مميز يمكن بة تمييز شكل المستوى ,
فيعرف بالنظر أن ذلك المستوى هو المستوى الفرعى الاول أو الثانى أو الثالث , أوغيرة .؟.
وكيف يكون مستوى طاقة يحمل مدار واحد , أن يكون أكبرفى الطاقة , من مستوى طاقة يحمل ثلاث أوخمس مدارات ؟. مع قربة أو بعدة عن النواة .
ومن الواضح أن التصنيف , كان على أساس ترتيب حسابى فقط , ليس بدون دليل علمى علية ,
وأن القائم بترتيب تصنيف المستويات كان يجتهد أن يجعل المستوى الفرعى بى ممتلأ , ليكون مميز للعنصر الخامل .
ولذلك كان يتم تغيير وضع المستوى اس أحيانا فى الترتيب الكلى للمستويات لذلك الغرض , ليمتلأ المستوى , بى , للعنصر الخامل .
رابعا:
هناك قاعدة هامة , مازالت معروفة حتى الآن .
وهى أن تكافؤ العنصر هو , عدد الالكترونات التى يفقدها أويكتسبها العنصر , ليصبح مماثلا لأقرب عنصر خامل .
التحليل :
بالتجارب المعملية , يمكن ملاحظة أن العناصر لاتفقد أوتكتسب أى الكترونات أثناء التفاعلات , وأن مايحدث هو عملية تكوين روابط أو انحلال روابط .
وعلى ذلك يمكن تعريف التكافؤ , بأنة : عدد الروابط التى يكونها العنصر , مع ذرة الهيدروجين .
خامسا:
تعريف مستوى الطاقة , والتصنيف الجديد لمستويات الطاقة .
ليس هناك تعريف واضح لمستويات الطاقة , أو قاعدة علمية سليمة للتصنيف حسب التصنيف المعروف اس , بى , دى , اف .
التحليل :
يمكن تعريف مستوى الطاقة , بأنة المسافة الكروية المتماثلة حول النواة التى يستطيع فيها العنصر تكوين أكبر عدد من الروابط مع الهيدروجين .
و بدراسة تكافؤات العناصر العشرة الاولى , وبمعرفة التركيب الداخلى للنواة
وبالأتفاق على أن تكافؤ الفلورأحادى وثلاثى , يكون هناك أربعة مستويات طاقة .
الهيدروجين والهيليوم مستوى الطاقة الاول .
الليثيوم والبريليوم والبورون والكربون مستوى الطاقة الثانى .
النيتروجين والاكسجين مستوى الطاقة الثالث .
الفلور والنيون مستوى الطاقة الرابع .
مع ملاحظة تداخل المستويين الثانى والثالث , والثالث والرابع ,
لتعدد تكافؤ النيتروجين والفلور .
مستويات الطاقة والجدول الدورى :
1 - تترتب العناصر فى الجدول الدورى , على أساس وجودها فى مستويات الطاقة الفرعية , المعروفة , اس , بى , دى , اف .,
ومع معرفة خطأ تصنيف مستويات الطاقة ,
فيلزم لذلك الغاء الشكل الحالى للجدول الدورى , وطرح شكل جديد للجدول الدورى لتصنيف العناصر,
يقوم على أساس سليم وصحيح علميا .
2 - ميزة وجود المستوى الفرعى , بى , ممتلأ بالالكترونات , مميزا للعنصر الخامل , هى قاعدة مصطنعة ليس لها أ ساس علمى , الا الترتيب والتنظيم ,
حتى أصبحت هى القاعدة , التى يترتب على أساسها ترتيب مستويات الطاقة , فيتقدم ذلك المستوى أو يتأخر ذلك , بدون ذكر سبب علمى لذلك .
3 - محاولة عمل رابطة بين العناصر فى الخواص , على أساس وجودها معا فى مربع مستوى طاقة واحد , قد يصح أحيانا , وقد لايصح أحيانا أخرى ,
لعدم وجود علاقة علمية سليمة , تقوم على أ ساسها هذة الرابطة .
ويمكننى القول بأن , خواص العناصر كلها تتأثر بعاملين أساسيين , هما :
أ - شحنة بروتونات الذرة , حيث تختلف الشحنة الموجبة للبروتونات للعناصر , سواء كان العنصرغاز, أو سلئل , أو صلب .
ب - الوزن الذرى للعناصر ونسبة عدد البروتونات الى النيترونات فى الذرة ,
لكن شرح تأثير هذين العاملين , فى خواص العناصر , لة تفاصيل كثيرة ,
منها ما هو مفصل فى شرح مقالة " شحنة البروتونات " ,
ومنها ما سيتم شرحها لاحقا بأذن اللة.
خاتمة:
قد تبدو بعض النقاط العلمية الجديدة , غريبة بعض الشيئ للمتخصصين , وذلك لعدم معرفتهم ببنية نواة الذرة .
لكن كل النقاط ستتضح صحتها ,
بعد معرفة البنية الصحيحة للذرة بأذن الله .
ملاحظة غريبة :
بملاحظة الاعداد الذرية للعناصر الخاملة وهى 2 , 10 , 18 , 36 , 54 , 86 ...
وبالقيام بعملية طرح , لمعرفة عدد العناصرالتى تملأ الدورات الست الأولى , من الدورات السبعة وهى :
2 , 8 , 8 , 18 , 18 , 32 .
وبالنظر للارقام غير المكررة نجد أنها هى : 2 , 8 , 18 , 32 .
سيلاحظ أنها هى عدد الاليكترونات , التى تملأ مستويات الطاقة الاربعة الاولى تماما ,
حسب معادلة مستويات الطاقة السابقة بالرغم من خطأها .
,,, وسبحان اللة .
__
عصام جاد