مبادىء النظرية الجديدة :
_______________
الجديد فى النظرية الجديدة
مبدأ تعادل الذرة
شحنة الذرة
شحنة البروتونات
نموذج ذرة الهيدروجين
بنية نواة ذرة الكربون – 12
تحليل معادلة اليكترونات مستويات الطاقة
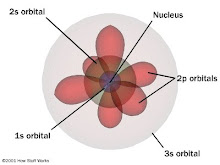
التصنيف الجديد لمستويات الطاقة
أول نموذج صحيح لنواة ذرة فى العالم
تعريفات جديدة
تصنيف الروابط الكيميائية
قاعدة تكافؤ العناصر
حقيقة القنبلة الهيدروجينية
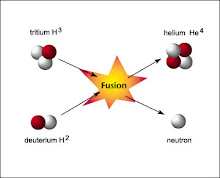
حقيقة الأندماج النووى
معلومات جديدة عن الأنشطاروالأندماج النووى
معادلة الطاقة المشهورة لأينشتين
ارشاد للعلماء فى مجال دراسة الجسيمات الذرية
اعلان ورسالة
عرض لشرح تفاصيل مبادىء النظرية الجديدة
دعوة مفتوحة للنشر
الى نوبل 2009
الله والمادة
التعريف بصاحب النظرية
بسم الله الرحمن الرحيم
النظرية الجديدة لبنية الذرة
هى نظرية جديدة فى بنية الذرة , تحتوى على مفاهيم جديدة فى بنية الذرة , وشرح لمبادىء قديمة .
It,s new theory in structure of the atom , has a new concepts in structure of the atom , and explanations to old principles .
______________________________________________
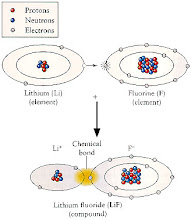
*** كل النماذج المعروضة فى العالم - لذرات ليست ذات بنية صحيحة " مصفوفة عشوائية لجسيماتها " .
...
· ان العلم المادى الذى يتوفر فى أيد الناس قد توصلوا ألية بعد اذن الله بة , جيلا بعد جيل , بالتجارب والملاحظة والبحث والدراسة . وانة من المهم لمن أراد أن يترك أثرا ماديا يدل علية , أن يعمل عملا نافعا يخدم الناس ويذكر الجيل القادم بة . وان من الأهمية بمكان أن يتذكر العلماء أن الحياة الآخرة هى دار البقاء والخلود , فعليهم أن يتذكروا الله فى أعمالهم لينالوا بذلك رضا الله عنهم , ثم ذكر الناس لهم بالثناء الجميل .. ________________________________________
· ان العلم المادى الذى يتوفر فى أيد الناس قد توصلوا ألية بعد اذن الله بة , جيلا بعد جيل , بالتجارب والملاحظة والبحث والدراسة . وانة من المهم لمن أراد أن يترك أثرا ماديا يدل علية , أن يعمل عملا نافعا يخدم الناس ويذكر الجيل القادم بة . وان من الأهمية بمكان أن يتذكر العلماء أن الحياة الآخرة هى دار البقاء والخلود , فعليهم أن يتذكروا الله فى أعمالهم لينالوا بذلك رضا الله عنهم , ثم ذكر الناس لهم بالثناء الجميل .. ________________________________________
ملاحظة :
· يمكن الأطلاع وقراءة مبادىء النظرية الجديدة الموجودة فى الجدول, بالضغط على العنوان الذى يدل على كل بند فى الدليل الموجود فى يسار تلك الصفحة .
__________________________________________________________________
Essam gad – kafr el sheikh – Egypt ... عصام جاد – كفرالشيخ – مصر esamgad_2@yahoo.com